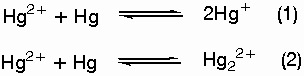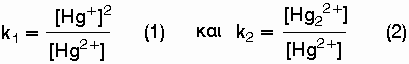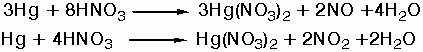ΧΗΜΙΚΕΣ
ΙΔΙΟΤΗΤΕΣ ΚΑΙ ΕΝΩΣΕΙΣ ΤΟΥ
ΥΔΡΑΡΓΥΡΟΥ
Ηg2Ο ΗgΟ
Ηg2Cl2
ΗgCl2
Hg2I2 HgI2
HgS
Hg2(NO3)2
Hg(NO3)2
RHgX RHgR'
Ο Hg έχει μικρή
τιμή
ηλεκτροθετικότητας
και επομένως χαρακτηρίζεται
ως μάλλον αδρανές
στοιχείο.
Ο μεταλλικός Hg
αντιδρά με τον
αέρα στους 350°
C (δηλαδή κοντά
στο σημείο
ζέσεως) προς
κόκκινο HgO:
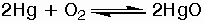
Δεν
αντιδρά με τους
υδρατμούς.
Με τα αλογόνα
αντιδρά και
δίνει άλατα του
Hg2+
σύμφωνα με την
αντίδραση:
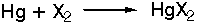
όπου Χ: F, Cl, Br, I.
Τα αλογονίδια
του Hg2+
είναι λευκά
πλην του HgI2
που είναι
κόκκινος.
Δεν αντιδρά με
κατιόντα
υδρογόνου,
δηλαδή δεν
αντιδρά με
διαλύματα
υδροχλωρικού
οξέος ή με
αραιό διάλυμα H2SO4.
Αντιδρά όμως με
διαλύματα HNO3
καθώς και με
πυκνό διάλυμα H2SO4.
Κατά την
επίδραση
αραιού και
ψυχρού
διαλύματος HNO3
(πυκνότητας 1,2 g/mL)
παράγεται Hg2(NO3)2
σύμφωνα
με την
αντίδραση:
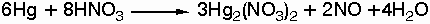
Κατά την
επίδραση
πυκνού και
θερμού
διαλύματος HNO3
παράγεται Hg(NO3)2
σύμφωνα με τις
αντιδράσεις:
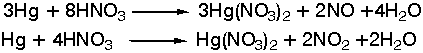
Με την
επίδραση
πυκνού και
θερμού
διαλύματος H2SO4
γίνεται η
αντίδραση:
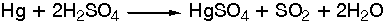
Ο Hg δεν
αντιδρά με ΚΟΗ
ή NaOH.
Από τα
προηγούμενα
φαίνεται ότι ο Hg
σχηματίζει δύο
κατηγορίες
αλάτων, εκείνα
του
μονοσθενούς
και εκείνα του
δισθενούς Hg. Τα
άλατα του
μονοσθενούς Hg
περιέχουν το
διατομικό
κατιόν Hg22+
το οποίο
προκύπτει από
την συνένωση
ενός κατιόντος
Hg2+
και ενός ατόμου
Hg. Στο
συμπέρασμα
αυτό
καταλήγουμε
μετά από
εξέταση του Hg2Cl2
με ακτίνες Χ.
Στο
ίδιο
συμπέρασμα
καταλήγουμε
και από τη
μελέτη της
ισορροπίας
μεταξύ των
κατιόντων του
δισθενούς
υδραργύρου, των
ατόμων του
υδραργύρου και
των κατιόντων
του
μονοσθενούς
υδραργύρου. Η
ισορροπία αυτή
προκύπτει από
την προσθήκη
μεταλλικού Hg σε
διάλυμα HgCl2.
Τα πιθανά
συστήματα
ισορροπίας
είναι:
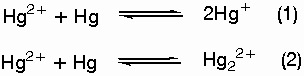
Με δεδομένο
ότι η
συγκέντρωση
του μεταλλικού
Hg θεωρείται
σταθερή, από το
νόμος δράσεως
των μαζών για
καθένα από τα
προηγούμενα
συστήματα
παίρνουμε:
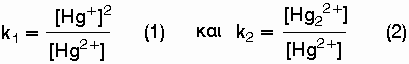
Από μελέτες
της τιμής της
σταθεράς k
προέκυψε ότι η
ισορροπία που
λαμβάνει χώρα
είναι η (2).
Επομένως το
σύστημα
περιέχει το
κατιόν Hg
22+.
Οι κυριότερες
ενώσεις του
υδραργύρου
είναι:
Το οξείδιο του
μονοσθενούς
υδραργύρου,
Ηg2Ο, έχει
χρώμα λευκό και
σημείο τήξης 100°
C.
Παράγεται
κυρίως από την
αντίδραση
αλάτων του
μονοσθενούς
υδραργύρου με
καυστικά
αλκάλια.
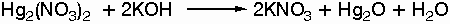
Το
οξείδιο αυτό
αποσυντίθεται
εύκολα με την
επίδραση φωτός,
προς Ηg και ΗgΟ:
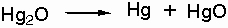
.GIF)
Το
οξείδιο του
δισθενούς
υδραργύρου,
ΗgΟ, έχει σημείο
τήξης 500° C.
Εμφανίζεται
κυρίως με δύο
μορφές: ως
κρυσταλλικό με
κόκκινο χρώμα
και ως άμορφο
με κίτρινο
χρώμα.
Η
κρυσταλλική
μορφή
παράγεται
κυρίως κατά την
παρατεταμένη
θέρμανση του Ηg
στον αέρα:
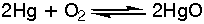
Το άμορφο
ΗgΟ παράγεται
κατά την
επίδραση
καυστικών
αλκαλίων σε
άλατα του
δισθενούς
υδραργύρου:
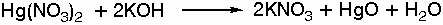
.GIF)
Χλωριούχος
μονοσθενής
υδράργυρος ή
χλωριούχος
υδράργυρος ( Ι ) Ηg
2Cl2
: ονομάζεται
ακόμη
χλωριούχος υφυδράργυρος ή
καλομέλας (εμπειρικό
όνομα). Έχει
χρώμα λευκό και
σημείο τήξης
383°
C.
Παράγεται
κυρίως κατά την
καταβύθιση
ιόντων Hg22+
από ιόντα Cl -
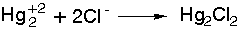
O Ηg2Cl2
διαλύεται
ελάχιστα στο
νερό.
Με την
επίδραση φωτός
διασπάται
μερικώς προς HgCl2
και Hg:
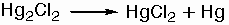
Με
την επίδραση
διαλύματος
αμμωνίας δίνει
μαύρο ίζημα
H2NHg HgCl :
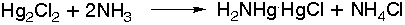
Δεν είναι
δηλητηριώδης
και
χρησιμοποιείται
ως φάρμακο (καθαρτικό
και
αντιφλογιστικό).
Χρησιμοποιείται
ακόμη για την
κατασκευή ηλεκτροδίων
καλομέλανος.
.GIF)
Χλωριούχος
δισθενής
υδράργυρος ή
χλωριούχος
υδράργυρος ( ΙΙ )
ΗgCl2
Το
εμπειρικό του
όνομα είναι
σουμπλιμέ. Έχει
χρώμα λευκό,
σημείο τήξης 280°
C, είναι αρκετά
διαλυτός στο
νερό και πολύ
ισχυρό
δηλητήριο.
Τα υδατικά
του διαλύματα
έχουν πολύ
μικρή
αγωγιμότητα,
διότι οι δεσμοί
του είναι
περισσότερο
ομοιοπολικοί.
Παράγεται
κατά την
επίδραση
υδροχλωρικού
οξέος σε
οξείδιο του
υδραργύρου:

Με
περίσσεια
ιόντων χλωρίου
δίνει σύμπλοκα
του τύπου [HgCl3]
-
και [HgCl4]- .GIF)
Ιωδιούχος
μονοσθενής
υδράργυρος ή
ιωδιούχος
υδράργυρος ( Ι ) Hg2I2.
Έχει χρώμα
κίτρινο και
σημείο τήξης 140°
C.
Παράγεται κατά
την καταβύθιση
ιόντων Hg22+,
από ιόντα I - :
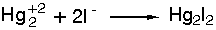
Διασπάται
μερικώς σε HgI2
και Hg.
Με
περίσσεια
ιόντων I-
δίνει σύμπλοκο:
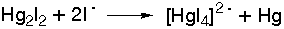
.GIF)
Ιωδιούχος
δισθενής
υδράργυρος ή
ιωδιούχος
υδράργυρος ( ΙΙ ) HgI2.
Έχει χρώμα
κόκκινο και
σημείο τήξης 257°
C. Είναι
δυσδιάλυτος
στο νερό,
διαλύεται όμως
σημαντικά στην
αιθυλική
αλκοόλη και τον
διαιθυλαιθέρα,
γεγονός που
αποδεικνύει
την
ομοιοπολικότητα
των δεσμών του.
Η
ομοιοπολικότητα
των δεσμών
αποδεικνύεται
ακόμη, από τη
μικρή
αγωγιμότητα
των υδατικών
του διαλυμάτων.
Παράγεται κατά
την καταβύθιση
ιόντων Hg2+,
από ιόντα I -
:
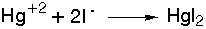
Με περίσσεια
ιόντων I-
δίνει σύμπλοκο:
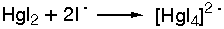
Από το
σύμπλοκο αυτό
με διάλυμα KOH
προκύπτει το αντιδραστήριο
Nesler το οποίο με
ίχνη αμμωνίας ή
κατιόντων
αμμωνίου δίνει
κίτρινο χρώμα,
ενώ με
μεγαλύτερες
ποσότητες
καστανό ίζημα,
σύμφωνα με την
αντίδραση:
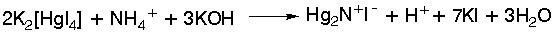
.GIF)
Θειούχος
υδράργυρος ( ΙΙ )
HgS
. Έχει χρώμα
μαύρο και
σημείο τήξης 344°
C. Είναι
δυσδιάλυτος
στο νερό.
.GIF)
Νιτρικός
μονοσθενής
υδράργυρος ή
νιτρικός
υδράργυρος ( Ι )
Hg2(NO3)2.
Έχει χρώμα
λευκό και είναι
ευδιάλυτος στο
νερό.
Παρασκευάζεται
κατά την
επίδραση
αραιού και
ψυχρού
διαλύματος HNO3
σε Hg:
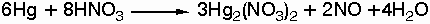
Επειδή με την
επίδραση του
ατμοσφαιρικού
αέρα
οξειδώνεται
εύκολα προς Hg(NO3)2
,
για να
διατηρηθεί σε
υδατικό
διάλυμα,
προστίθεται σ'
αυτό μικρή
ποσότητα Hg.
.GIF)
Νιτρικός
δισθενής
υδράργυρος ή
νιτρικός
υδράργυρος (ΙΙ)
Hg(NO3)2.
Έχει χρώμα
λευκό και είναι
ευδιάλυτος στο
νερό.
Παρασκευάζεται
κατά την
επίδραση σε Hg
πυκνού και
θερμού
διαλύματος
νιτρικού οξέος:
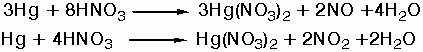
.GIF)
Μονοαλκυλικές
οργανομεταλλικές
ενώσεις του
υδραργύρου (ΙΙ)
RHgX.
Είναι
κρυσταλλικές
ενώσεις
αδιάλυτες στο
νερό.
Προκύπτουν από
την επίδραση Hg
σε
αλκυλαλογονίδια:
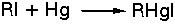
Χρησιμοποιούνται
σε διάφορες
οργανικές συνθέσεις.
.GIF)
Διαλκυλικές
οργανομεταλλικές
ενώσεις του
υδραργύρου (ΙΙ) RHgR'.
Είναι υγρές,
αδιάλυτες στο
νερό, πτητικές,
έχουν
δυσάρεστη οσμή
και ισχυρώς
τοξική δράση.
Προκύπτουν
από την
επίδραση HgCl2
σε
οργανομαγνησιακές
ενώσεις:

Χρησιμοποιούνται
σε διάφορες
οργανικές συνθέσεις.
.GIF)